
Toxicologie Génétique Préclinique
Introduction
L’approbation réglementaire de nouveaux médicaments nécessite une preuve de sécurité pour la consommation humaine. Pour prouver qu’un médicament est sûr, il doit être démontré qu’il est absorbé, distribué, métabolisé et excrété en toute sécurité par l’organisme sans endommager les systèmes organiques, déclencher des réponses immunitaires dangereuses ou causer des effets négatifs à long terme sur la santé.
La toxicologie génétique est l’un des nombreux domaines des tests de sécurité précliniques dans lesquels les dommages causés aux gènes et aux chromosomes par des médicaments et des produits chimiques sont évalués. Aujourd’hui, le développement de médicaments nécessite des tests de toxicologie génétique pour servir d’estimation de la cancérogénicité potentielle.
Dans ce bulletin, nous examinerons un bref historique de la toxicologie génétique en tant que domaine, nous décrirons les formes courantes de toxicité génétique, les tests courants de génotoxicité et nous présenterons les capacités d’ITR en matière de tests de toxicologie génétique.

Histoire de la Toxicologie Génétique
L’histoire de la toxicologie génétique a commencé dans les années 1930 en Union soviétique. Dans les années 1960, une masse critique de données avait été accumulée et en 1969, l’Environmental Mutagenesis & Genomics Society a été fondée aux États-Unis. Cela s’est finalement transformé en recherche interdisciplinaire en santé au travail, en toxicologie, en génétique et en biochimie des composés étrangers. Au début des années 1970, la Société européenne des mutagènes environnementaux a été formée, ainsi que d’autres sociétés de mutagènes dans d’autres pays.
À l’heure actuelle, plus de 100 méthodes d’évaluation de l’activité génétique des composés chimiques ont été développées, mais la majorité a été abandonnée et une vingtaine de tests sont toujours utilisés. Comme pour les autres tests toxicologiques, les tests directs chez l’homme ne sont pas possibles, à la place, les micro-organismes, les modèles animaux, les plantes et les cellules in vitro de mammifères et d’humains servent de substituts. L’étalon-or pour les tests était les rats et les souris de laboratoire en raison de leur relation phylogénétique avec les humains. Cependant, le temps et les coûts associés aux tests sur les rongeurs ont posé des problèmes avec la quantité de produits chimiques nécessitant des tests. Ainsi, la tendance actuelle est de valider les tests de toxicité génétique à l’aide de bactéries et de cellules humaines (lymphocytes frais en culture et modèles tissulaires 3D).

Formes Courantes de Toxicologie Génétique
La génotoxicité se caractérise par des dommages au matériel génétique. Ces dommages se manifestent par des mutations, des cassures simple ou double brin, des liaisons croisées, une perte de réparation par excision et des aberrations chromosomiques.
La mutation est l’altération d’une séquence d’ADN résultant d’une exposition à des mutagènes, à des agents cancérigènes, à des radiations ou à des erreurs lors de la réplication de l’ADN. Ces erreurs peuvent entraîner des problèmes de synthèse des protéines, créant des protéines non fonctionnelles ou partiellement fonctionnelles. Les mutations peuvent entraîner la mort cellulaire, ou elles peuvent entraîner une altération permanente du code génétique, entraînant de futures cellules germinales porteuses des mêmes mutations. Selon les protéines affectées, des conditions médicales graves peuvent se manifester.
La clastogénicité est une forme de mutation qui se caractérise par une rupture ou une rupture des chromosomes. Une rupture simple ou double brin peut entraîner une réticulation, un réarrangement, une suppression ou des ajouts aux chromosomes. L’exposition au clastogène augmente la fréquence des anomalies du développement chez les fœtus en raison de cellules germinales anormales et peut entraîner une cancérogénicité.
L’aneuploïdie est caractérisée par un nombre anormal de chromosomes dans une cellule qui se produit à la suite d’erreurs lors de la division cellulaire. Les 46 chromosomes standard chez l’homme peuvent devenir 45 ou 47, se manifestant par des malformations congénitales telles que le syndrome de Klinefelter, le syndrome de Down et le syndrome d’Edwards.

Tests Courants de Toxicité Génétique
Le test de mutation inverse bactérienne d’Ames (Fig.1) teste la mutagénicité en exposant des bactéries génétiquement modifiées à des composés potentiellement mutagènes. Les bactéries utilisées sont mutées artificiellement et sont incapables de se reproduire en l’absence d’histidine (Salmonella) et de tryptophane (E. coli WP2 uvrA). Lorsqu’elles sont exposées à des mutagènes, les bactéries retrouveront la capacité de se reproduire sur un milieu gélosé en l’absence de ces acides aminés. Lorsque le composé d’intérêt est toxique pour les bactéries, comme avec des antibiotiques, un test Pig-A peut être utilisé pour tester les érythrocytes mutants chez les mammifères. Nécessitant de faibles volumes sanguins et évalués par cytométrie en flux, les tests Pig-A sont rapides et efficaces.
-
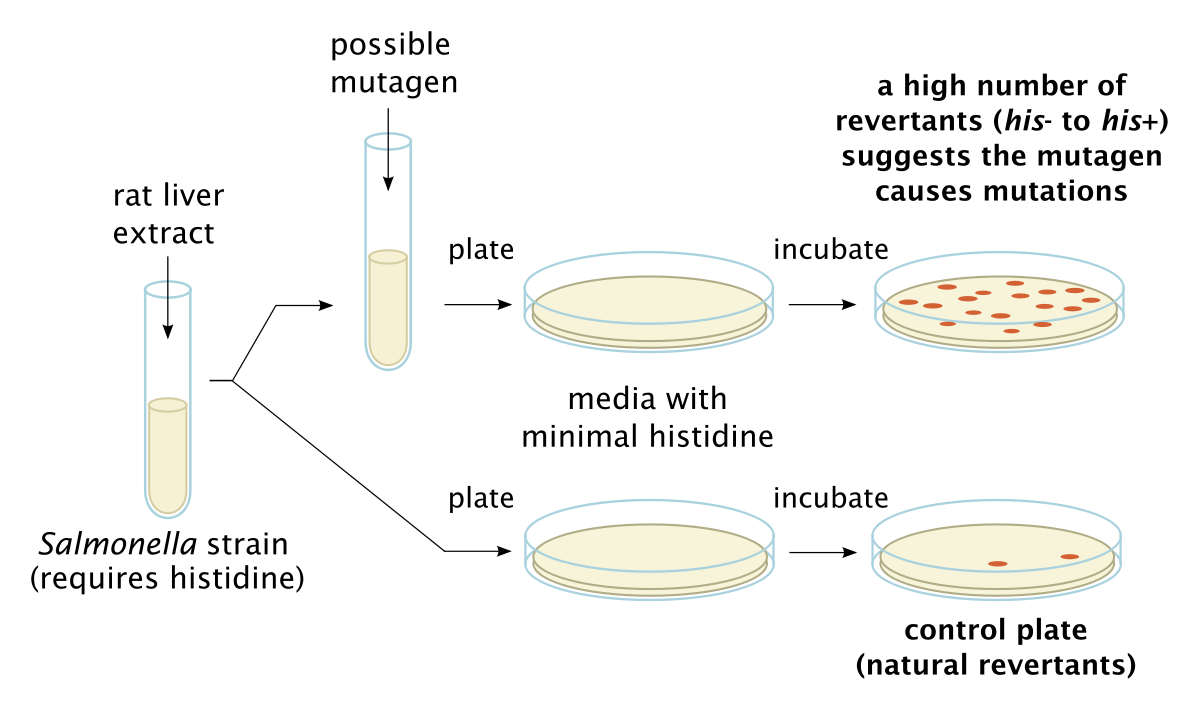
Fig 1: AMES Test -
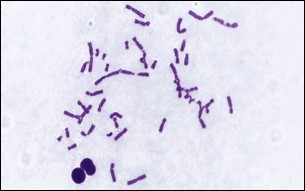
Fig 2: Chromosomal Aberration Assay
Le test Chromosomal Aberration Assay (Fig.2) est conçu pour évaluer le potentiel d’un composé test à induire des anomalies chromosomiques structurelles telles que des cassures et des échanges.
Le test du micronoyau (Fig.3) mesure la présence de micronoyaux. Les micronoyaux apparaissent lorsqu’il y a des erreurs lors de la division cellulaire. Au lieu d’une cellule se divisant uniformément en deux cellules identiques, une cellule manquera d’un chromosome entier ou aura un chromosome partiel. Le ou les chromosomes manquants formeront leur propre micronoyau dans le cytoplasme, résultant en un gros noyau et un petit noyau. Les tests du micronoyau sont effectués avec de la moelle osseuse ou des cellules sanguines périphériques.
Le test des comètes (Fig.4) est une méthode d’électrophorèse sur gel utilisée pour visualiser et mesurer les ruptures de brins d’ADN induites par des mutagènes dans des cellules individuelles à l’aide de la microscopie. La rupture est mesurée grâce à l’utilisation d’un système d’électrophorèse pour éloigner l’ADN fracturé du noyau de la cellule. L’ADN contient une charge négative et l’ADN fracturé est tiré vers l’anode chargée positivement, laissant une apparence de queue de comète lorsqu’il est coloré par fluorescence.
-
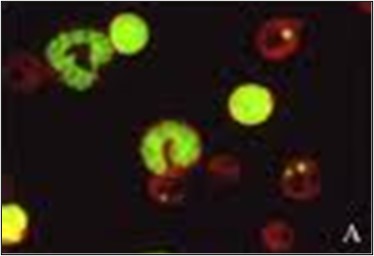
FIg 3: Micronucleus Assay -
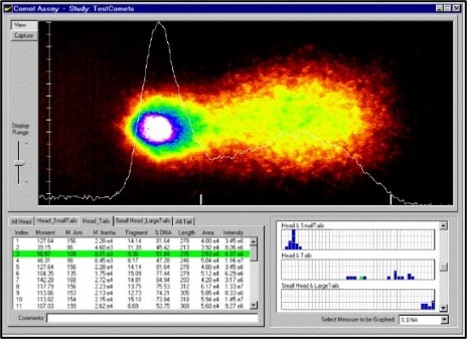
Fig:4 Comet Assay

Capacités de Toxicologie Génétique d’ITR
ITR est équipé de deux laboratoires de niveau de sécurité biologique 2, de deux cytomètres en flux BD FACSCanto II, d’un compteur de colonies automatisé ProtoCOL 3, d’une microscopie à fluorescence, du logiciel COMET Assay IV et d’un système d’électrophorèse.
Nous pouvons effectuer une variété de tests in vivo et in vitro pour tester la génotoxicité, notamment : test de mutation inverse bactérienne, test de micronoyau in vitro, test d’aberration chromosomique, tests de micronoyau et de comète in vivo. Nous pouvons également effectuer le test de mutation Pig-a-gene et des tests de dépistage. Les tests de dépistage sont des alternatives rentables pour évaluer la génotoxicité et le potentiel cancérogène des produits pendant la phase de recherche et développement.
Nous proposons des packages flexibles avec des mélanges de tests in vivo et in vitro pour répondre aux exigences réglementaires en matière de tests pour les soumissions IND.

Exigence Réglementaire Standard
La Conférence internationale sur l’harmonisation des exigences techniques pour l’enregistrement des produits pharmaceutiques à usage humain (ICH) a approuvé de nouvelles directives S2 (R1) sur les tests de génotoxicité et l’interprétation des données pour les produits pharmaceutiques à usage humain. Selon ces directives révisées ICH S2 (R1), la batterie standard de toxicologie génétique comprend les tests de génotoxicité suivants qui sont proposés à l’ITR.

Conclusion
Le dépistage toxicologique génétique est exigé par tous les organismes de réglementation responsables des tests de sécurité des produits chimiques et pharmaceutiques. Avec plus de 100 études de toxicologie génétique réalisées avec succès, ITR est bien équipé pour effectuer une variété de tests in vivo et in vitro pour les dommages chromosomiques et les mutations génétiques.
ITR augmente régulièrement son expertise et ses services de laboratoire pour offrir une expérience de guichet unique pour aider nos clients à acheminer leurs composés en douceur et rapidement à la clinique.



