
Analyse & Bioanalyse en Médicament Préclinique Développement
Analyse & Bioanalyse en Médicament Préclinique Développement
Les sciences analytiques et bioanalytiques jouent un rôle central dans le soutien du processus de développement de médicaments dans les contextes cliniques et précliniques. De la vérification des niveaux de dosage précis à la mesure des niveaux de concentration de médicaments dans les matrices biologiques, les outils analytiques fournissent des informations essentielles pour garantir que les médicaments sont sûrs et efficaces.
Dans ce bulletin, nous discuterons d’un historique général des technologies analytiques, décrirons leur rôle dans le processus de développement de médicaments, expliquerons les techniques courantes de séparation et de détection et présenterons les capacités analytiques et bioanalytiques des ITR.
Histoire Générale des Technologies Analytiques
La bioanalyse a toujours été utilisée pour évaluer la présence de médicaments dans les fluides biologiques à des fins de toxicologie médico-légale. Le développement de la pharmacocinétique dans les années 1930 a propulsé l’intérêt pour la bioanalyse pour l’évaluation de nouveaux candidats-médicaments. Les premiers tests manquaient de spécificité, ce qui présentait des complications dans la différenciation entre un médicament et ses métabolites. La différenciation entre les médicaments et leurs métabolites a gagné en importance lorsque certains métabolites se sont avérés toxiques ou ont une valeur thérapeutique distincte.
Le développement de méthodes chromatographiques pour séparer les médicaments de leurs métabolites a commencé dans les années 1940 avec la chromatographie sur papier, suivie de la chromatographie en phase gazeuse (GC) dans les années 1950. La GC est rapidement devenue une technique de base pour l’analyse médico-légale et pharmaceutique car elle offrait des améliorations de sensibilité et de sélectivité avec des détecteurs plus sensibles devenant disponibles, y compris des spectromètres de masse. La chromatographie en phase gazeuse nécessitait cependant des analytes volatils et thermostables ainsi qu’une préparation d’échantillon complexe, ce qui limitait son utilité.
La fin des années 1960 et le début des années 1970 ont vu le passage de la chromatographie en phase gazeuse à la chromatographie liquide à haute pression (HPLC). Cette nouvelle méthode de séparation associée au développement de détecteurs ultraviolets et fluorescents a fourni une plus grande sensibilité pour correspondre à la puissance croissante des médicaments en cours de développement au cours des années 1970 et 1980.
Le Rôle des Sciences Analytiques et Bioanalytiques dans le Développement de Médicaments
Dans les milieux précliniques et cliniques, les médicaments sont rarement administrés sous leur forme pure. L’ingrédient pharmaceutique actif (IPA) est souvent livré dans un véhicule ; le médicament est dissous dans une solution, dilué ou enfermé dans une capsule pour administration orale, parmi d’autres méthodes courantes d’administration. Au cours des essais cliniques et précliniques, la concentration de l’API doit être vérifiée par une analyse de la formulation de la dose pour s’assurer que la bonne dose est administrée. L’analyse de la formulation de la dose nécessite la séparation de l’API du véhicule et des autres impuretés afin que la concentration correcte du médicament puisse être mesurée.
Afin d’évaluer la biodisponibilité et le devenir du médicament dans le système biologique, des données sont recueillies en analysant des échantillons de fluides biologiques prélevés sur des humains ou des animaux dosés. Une analyse précise de la concentration du médicament dans les fluides biologiques nécessite la séparation du médicament du fluide biologique.
Aujourd’hui, ces types d’analyses sont le plus souvent réalisées par chromatographie en phase gazeuse ou liquide en tandem avec différents détecteurs.
HPLC, GC, & MS – Outils Analytiques de Séparation et d’Analyse
Les outils analytiques utilisés aujourd’hui sont composés d’une méthode de séparation et d’un détecteur. La sélection d’un outil différera en fonction des propriétés chimiques du médicament, du véhicule et de la méthode d’administration. La méthode de séparation la plus fréquemment utilisée aujourd’hui est la chromatographie liquide à haute pression (HPLC).

La HPLC utilise des tubes en acier inoxydable, ou colonnes, pour loger un matériau absorbant à faible granulométrie : la phase stationnaire. Une pompe à haute pression est utilisée pour pomper un solvant à travers la phase stationnaire, le solvant est appelé phase mobile. L’échantillon d’intérêt est injecté dans la phase mobile et le mouvement de la phase mobile à travers la phase stationnaire dans la colonne entraîne la séparation des différents composants de l’échantillon lorsqu’ils se déplacent à travers les colonnes à des vitesses différentes en raison des différences d’affinité avec le état stationnaire.
Au bout de chaque colonne se trouve un détecteur ; le type de détecteur utilisé dépend de l’échantillon à analyser. Le détecteur capte chaque composant de l’échantillon individuellement en fonction du temps qu’il leur faut pour traverser la colonne ou de leur temps de rétention. Le logiciel informatique génère ensuite un pic graphique pour afficher les données de détection recueillies.
Chacun de ces pics identifie un composant distinct (médicament, métabolite, impureté ou véhicule) et l’aire sous la courbe de chaque pic révèle la concentration du composant correspondant. Afin d’identifier clairement chaque composant, les temps de rétention doivent être connus à l’avance sur la base de normes préalablement établies ou d’essais de développement de méthodes. La HPLC est donc plus efficace lorsque les analystes savent déjà ce qui est contenu dans l’échantillon et que le but de la mesure est de confirmer les proportions des composants.
Lorsqu’il s’agit d’échantillons volatils, la chromatographie en phase gazeuse (GC) est utilisée à la place de la chromatographie liquide. En effet, les échantillons volatils peuvent être correctement contenus dans un système GC où ils ne peuvent pas être contenus avec la chromatographie liquide. En GC, un gaz inerte est utilisé comme phase mobile, les échantillons sont vaporisés et mélangés avec le gaz inerte, puis passés à travers des colonnes chauffées pour s’assurer que le médicament est finalement élué. La séparation des composants est généralement supérieure à la HPLC et les spectromètres de masse servent souvent de détecteur, mais la détection par ionisation de flamme (FID) et la détection par conductivité thermique (CTD) sont également utilisées.

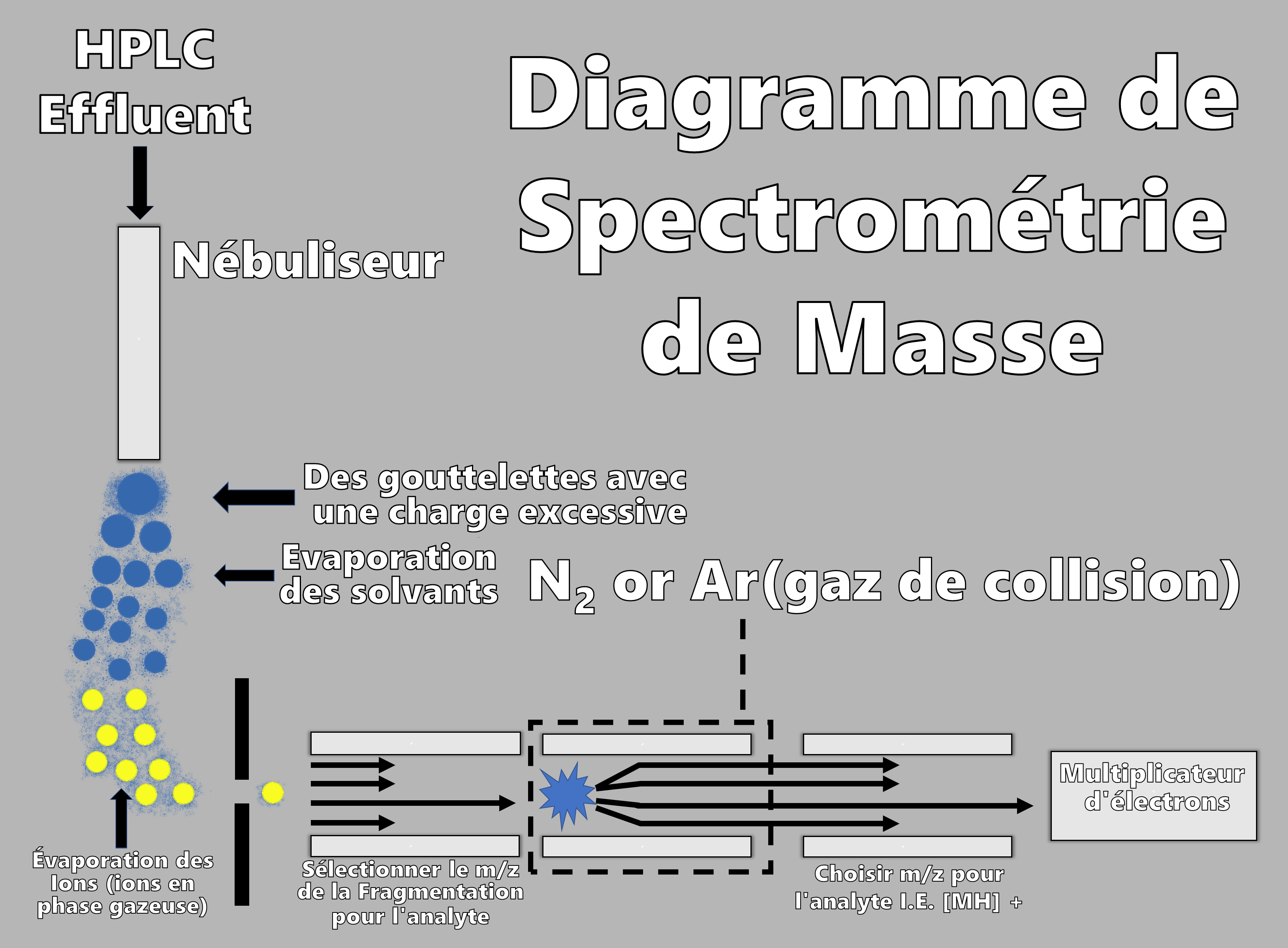
LCMS combine la séparation de HPLC avec la détection par spectrométrie de masse. La spectrométrie de masse est utilisée pour déterminer le poids moléculaire des composants séparés individuellement. Une fois l’échantillon séparé par chromatographie liquide, il entre dans le spectromètre de masse, où il est chauffé pour le transformer en une vapeur qui est simultanément ionisée. La vapeur ionisée est accélérée à travers un quadripôle (4 tiges métalliques également espacées) contenant un champ magnétique et enfin dans le multiplicateur d’électrons et le détecteur. Les atomes seront déviés par le champ magnétique et atteindront alors le détecteur en fonction de leur masse. La masse de chaque composant peut être balayée et un spectre de masse pour chaque instant peut être utilisé pour déterminer la composition de l’échantillon. Une plus grande sensibilité peut être obtenue en sélectionnant une seule masse représentative d’un médicament spécifique et en surveillant uniquement cette transition de masse. Une sélectivité améliorée et un rapport signal sur bruit amélioré sont obtenus en employant une cellule de collision et en surveillant un fragment de l’ion d’origine à l’aide d’un troisième quadripôle, qui représente la surveillance des ions de sélection ou LC-MS/MS. Le LCMS est couramment utilisé pour l’analyse de médicaments dans des échantillons biologiques afin de générer des données pharmacocinétiques (PK) et toxicocinétiques (TK). Il est particulièrement utile pour l’identification et la quantification de métabolites de médicaments qui ne sont pas toujours identifiés par d’autres techniques.
Capacités des ITR
Les départements analytiques et bioanalytiques d’ITR fournissent un soutien aux études précliniques et cliniques BPL et non BPL en proposant une analyse de la formulation des doses, une analyse des médicaments en aérosol et une analyse des échantillons biologiques pour soutenir la pharmacocinétique, la toxicocinétique et la biodistribution dans les échantillons biologiques.
L’équipe de formulation des doses d’ITR prend en charge les études de toxicologie générale pour toutes les voies d’administration ainsi que les études de toxicologie génétique. L’analyse de la formulation de la dose et le support des études d’inhalation sont effectués à l’aide des HPLC Waters Alliance avec des détecteurs de diffusion de lumière ultraviolette, de fluorescence et d’évaporation. Ces instruments sont utilisés pour analyser une large gamme de médicaments dans une variété de formulations, y compris des solutions et des suspensions. La gamme d’analyses de médicaments prises en charge a récemment été élargie avec l’ajout d’un nouveau UHPLC, offrant une résolution, une sensibilité et une vitesse d’analyse accrues.
L’équipe de bioanalyse de l’ITR travaille à partir d’une plateforme de plaques 96 puits. Les matrices couramment utilisées comprennent le sérum, le plasma, le sang total, l’urine, le liquide céphalo-rachidien, les extraits de tissus et l’humeur aqueuse/vitreuse. Les échantillons biologiques extraits sont préparés par précipitation des protéines, extraction liquide-liquide ou en phase solide, puis injectés dans l’un de nos trois systèmes LC-MS/MS Sciex 4000 identiques pour les études PK/TK. Des méthodes sont également conçues pour analyser d’éventuels échantillons cliniques, afin d’assurer un soutien continu pendant la transition du sponsor de la recherche préclinique à la recherche clinique.
Nous avons récemment fourni une nouvelle suite de bioanalyse LC-MS/MS et sommes en train d’installer un nouvel instrument Sciex 6500+. Ce nouvel équipement offre à ITR une sensibilité, une vitesse et des performances accrues, permettant l’analyse d’échantillons de plus en plus petits et d’une catégorie plus large de médicaments, y compris les protéines et les peptides. La nouvelle suite LCMS/MS aura également de la place pour trois machines Sciex 6500+ supplémentaires à acheter à l’avenir.

Le développement des technologies analytiques et bioanalytiques et leur application à l’industrie pharmaceutique ont fourni des outils puissants pour mieux caractériser les profils d’innocuité des nouveaux médicaments. À mesure que la nature et la puissance des produits pharmaceutiques changent, des machines de plus en plus sensibles ont été développées afin de suivre le rythme. ITR améliore également et développe continuellement ses services pour répondre aux besoins de ses clients.